
Hämatologie/Onkologie
Krebs bei Kindern und Jugendlichen ist vergleichsweise selten. Trotzdem erkranken in Deutschland ca. 2000 Kinder pro Jahr an Blutkrebs (Leukämien), Tumoren der Lymphknoten, Organen oder Knochen, sowie an Hirntumoren. Obwohl durch die Verbesserung der Behandlung heute 8 von 10 Kindern geheilt werden können, gibt es immer noch Tumorarten mit hohen Rückfallraten und schlechten Überlebenschancen. Um die Chancen weiter zu verbessern, werden in Deutschland alle Kinder und Jugendlichen in spezialisierten pädiatrisch-onkologischen Zentren (Kinderkrebszentren) behandelt, in denen sie von einem Team von Spezialisten (pädiatrischen Onkologen, Chirurgen, Strahlentherapeuten und speziell geschultem Pflegepersonal) betreut werden, die auf die speziellen Bedürfnisse von Kindern und ihren Familien eingehen können.
Klinische Studien
Es gibt verschiedenen Arten von klinischen Studien, in denen neue Behandlungsmethoden, oder Arzneimittel angewendet werden. Was in einer Arzneimittel-Studie herausgefunden wird, soll die Behandlung einer Krankheit oder den Schutz vor ihr verbessern – sei es durch ein neues Medikament oder eine bessere Anwendung schon bekannter Medikamente, die möglicherweise weniger Nebenwirkungen haben. Die Sicherheit der Teilnehmer hat bei einer klinischen Studie immer höchste Priorität und die Teilnahme an der Studie ist freiwillig.
Klinische Studien sind ein zentraler Bestandteil der Versorgung krebskranker Kinder. So werden in Deutschland mehr als 80% aller Kinder und Jugendlichen mit Krebserkrankungen in nationalen und internationalen klinischen Studien bzw. Registerstudien der Gesellschaft für Pädiatrische Hämatologie/Onkologie (GPOH) behandelt. Die Therapien entsprechen dem aktuellsten Standard und der bestmöglichen Behandlung der jeweiligen Erkrankung und unterliegen hohen Qualitätsanforderungen. Die Erkenntnisse die wir durch die genaue Beobachtung und Auswertung der gewonnenen Daten gewinnen, dienen der stetigen Verbesserung dieser Therapien.
Für Situationen, in denen keine standardisierte Therapie zur Verfügung steht besteht an unserer Klinik die Möglichkeit, an sog. frühen klinischen Studien (Phase I/II Studien) teilzunehmen
Die Aufgabe dieser Phase I/II Studien ist es, die Entwicklung neuer Therapien im frühesten Stadium zu beschleunigen und neue Arzneimittel und Behandlungsmethoden schneller für Kinder verfügbar zu machen.
Seit Mai 2015 ist unsere Klinik ein akkreditiertes Phase I/II Studienzentrum des europäischen Konsortiums ITCC (Innovative Therapies for Children with Cancer)
Es ist unser Anliegen, ihrem Kind die wirksamste und sicherste Krebstherapie zukommen zu lassen.
Bevor Sie ihre Zustimmung zu einer Studienteilnahme geben, werden die Ärzte all ihre Fragen beantworten und Ihnen alles zu dieser Studie erklären was Sie wissen müssen, u. a. zu der Behandlung, der Dauer und möglichen Nebenwirkungen. Falls Sie sich gegen eine Studienteilnahme entscheiden, wird ihre Ärztin, oder ihr Arzt mit Ihnen und Ihrem Kind auch über alternative Behandlungsmethoden sprechen.
Im Folgenden informieren wir Sie über die klinischen Studien, an denen unsere Klinik teilnimmt.
Als Partner im überregionalen pädiatrisch-onkologischen Forschungsverbund »Westdeutsches Pädiatrisches Studienzentrum (WPSZ)« zur gemeinsamen Durchführung von Phase I/II Studien möchten wir ihnen Beratung und Unterstützung von Arzneimittelentwicklungsprojekten und -studien in der pädiatrischen Hämatologie und Onkologie inklusive der Stammzelltransplantation, Supportivtherapie und Hämostaseologie anbieten.
Schreiben Sie uns gerne, wenn Sie weitere Informationen wünschen, per Email an paedonko-studien@uk-essen.de.
Netzwerke und Kooperationen
- GPOH (Gesellschaft für pädiatrische Onkologie und Hämatologie)
- ITCC (Innovative Therapies for Children with Cancer)
Aktuelle Studienangebote
- Teilnahme an allen multizentrischen Therapiestudien der GPOH
- Teilnahme am INFORM-Register INdividualized Therapy FOr RElapsed Malignancies in Childhood
- Teilnahme an der Studie Molekulare Neuropathologie 2.0 (MNP 2.0)
- Studie zur Knochengesundheit bei Kindern nach einer Krebserkrankung in Kooperation mit der Abt. Endokrinologie der Klinik für Kinderheilkunde II AG Kindliche Knochenerkrankungen, Ansprechpartner Prof. Dr. med. Michael Schündeln
- Teilnahme an Gerinnungsstudien
Studiengruppen
- Ewing Sarkome – Knochentumor (Prof. Dr. Uta Dirksen)
- Retinoblastome – Augentumore (Prof. Dr. Petra Ketteler)
- HIT-Rez Hirntumore Rezidive (Prof. Dr. Gudrun Fleischhack)
Studienteam

Isabell Dahlmann
Study Nurse
Studiendokumentation

Melanie Koch
Study Nurse/
Studiendokumentation

Dr. rer. medic.
Katrin Menke
Studienkoordination

Ruth Mikasch
Kinderkrankenschwester
Study Nurse
Studiendokumentation

Heidi Sprandel
Study Nurse/
Studiendokumentation
Klinische Forschung
Arbeitsgruppen der Hämato-Onkologie
Arbeitsgruppe Ewing-Sarkom
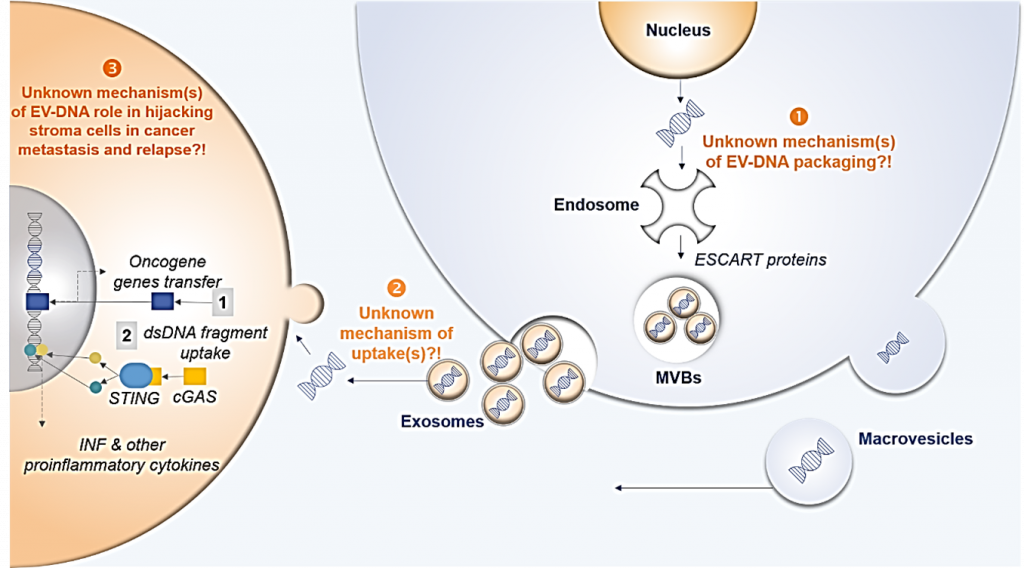
Wie kann man feststellen, ob die Therapie anschlägt? Insbesondere bei Hirntumoren war der Nachweis bisher nur mit bildgebenden Verfahren wie der Magnetresonanztomographie (MRT) möglich. Diese liefern jedoch nicht immer eindeutige Ergebnisse, weshalb die minimale Resterkrankung (MRD) möglicherweise nicht erkannt wird und Rückfälle auftreten können. An dieser Stelle setzt das Exosomen-Forschungsprojekt an. Exosomen sind kleine extrazelluläre Vesikel, die von allen Zelltypen im extrazellulären Raum freigesetzt werden. Sie sind in allen Körperflüssigkeiten vorhanden, einschließlich Blut, Urin, Speichel und Zerebrospinalflüssigkeit. PD Dr. Thakur fand heraus, dass sie doppelsträngige DNA enthalten, die die gesamte genomische DNA widerspiegelt (Thakur et al. Cell Research 2014). „Wir untersuchen, ob Exosomen, die die DNA der jeweiligen Tumorzellen enthalten, im Blut von kleinen Patienten während der Erkrankung nachweisbar sind“, erklärt Thakur. Gelingt es, diese Exosomen im Blut nachzuweisen, können sie zur Kontrolle des Krankheitsverlaufs herangezogen werden. Verschwinden sie, bedeutet dies, dass auch der Tumor verschwunden ist. In Zusammenarbeit mit der AML-BFM-Forschungsgruppe (unter Leitung von Prof. Dr. Dirk Reinhardt) hat das Team um PD Dr. Thakur eine Arbeitsgruppe initiiert, um exosomale dsDNA (exoDNA) als leistungsfähigen Biomarker zur Therapieüberwachung und zum Nachweis der minimalen Resterkrankung (MRD) bei pädiatrischer AML zu etablieren (Kunz et. al. Ann Hematol. 2019 und Kontopoulou et. al. Ann Hematol. 2020). Darüber hinaus konzentriert sich seine Arbeit auf den funktionellen Mechanismus, wie Krebs-Exosome von Zellen in der Tumormikroumgebung aufgenommen werden, was dann zu weiteren Veränderungen führt, die für die Entwicklung von Arzneimittelresistenz und Rückfällen bei Krebs erforderlich sind (Chetty et. al. Cancers. 2022). Ein besseres Verständnis der Exosom-basierten Kommunikation bei Krebs wird zur Entwicklung einer neuartigen Arzneimitteltherapie in der Krebsprävention beitragen (Ghanam et. al. Cell Biosciences. 2022).
Exosomen in pädiatrischen Hirntumoren
Doppelstrangige DNA (dsDNA) in extrazellulären Vesikeln (Exosomen) als potenzieller diagnostischer und prognostischer Biomarker bei Hirntumoren im Kindesalter.
Von Tumorzellen stammende Exosomen (Vesikel) haben sich als potenziell wertvolle Biomarker erwiesen, da sie krankheitsspezifische Proteine, Lipide und genomische Signaturen enthalten, die die jeweilige Ursprungszelle repräsentieren. Dies macht sie potenziell wertvoll für die Überwachung des Therapieansprechens oder die Erkennung eines möglichen Therapieversagens oder -rückfalls. Ziel unseres Projekts ist es, anhand der genetisch gut definierten Gruppe von Hirntumoren im Kindesalter, wie z. B. Rhabdoid- und Medulloblastom, zu zeigen, dass Exosomen, die DNA der Tumorzellen enthalten, im Blut nachweisbar sind und zur Überwachung des Krankheitsverlaufs verwendet werden können. Diese Erkenntnisse werden in Zellkulturen und verschiedenen Mausmodellen gewonnen und anschließend auf den Patienten übertragen und in einer klinischen Studie ausgewertet. Nach der Etablierung dieser Methode am Beispiel dieses hochgradig bösartigen Tumors im Kindesalter könnten diese Erkenntnisse auf andere solide Tumoren, einschließlich anderer Hirntumoren im Kindes- und Erwachsenenalter, übertragen werden. Etablierung eines diagnostischen Ansatzes unter Verwendung von extrazellulären Vesikeln (EVs) als potentielle Biomarker bei pädiatrischen Hirntumoren und deren funktionelle Charakterisierung (In Klinischer Zusammenarbeit mit Dr. med. Stephan Tippelt und Prof. Dr. med. Gudrun Fleischhack).
Daher beschäftigt sich das Labor mit Grundlagenforschung mit translationaler Perspektive, um folgende Schlüsselfragen im Zusammenhang mit Exosomen anzugehen:
- Identifizierung, Reinigung und Charakterisierung von krebsspezifischen EV, die den größten Teil der dsDNA tragen und als klinische Biomarker und funktionelle Helfer dienen.
- Mechanismus(e) der dsDNA-Übertragung von EV in die Empfängerzellen.
- Funktionelle Konsequenzen der dsDNA-Interaktion von EV mit Krebsnischen.

Laborleitung

PD Dr.
Basant Kumar Thakur
Wissenschaftliche Mitarbeiter

Frida Kaußen
cand. MSc.

Dr. med.
Laura Reetz
cand.

Dr.
Jamal Ghanam
Ph.D.

Dr.rer.nat.
Venkatesh Kumar Chetty

Dr.
Katarina Reinhardt
Ph.D.
Frau Sarah Jennrich, cand. Dr. med.
(Jointly supervised by PD. Dr. Justine Rudner and Prof. Dr. Verena Jendrossek, Institut für Zellbiologie, Tumorforschung)
Herr Marvin Droste, cand. Dr. med.
(Jointly supervised by PD. Dr. med. Anja Katja Büscher, Klinik für Kinderheilkunde II)
Ehemalige Mitarbeiter
- Dr. med. Yannick Lippke
- Dr. rer. nat. Tino Dittrich
- Dr. rer. nat. Marius Bruer, Ph.D.
- Herr Divakarvel Selvakumar, B. Pharm.
- Frau Èlia Bosch Borràs, M.Sc.
- Herr Dimitrios Alexandros Katelas, M.Sc.
- Frau Maren Soldierer, M.Sc.Dr. med. Fabienne Kunz
- Dr. rer. nat. Evangelia Kontopoulou, Ph.D.
- Dr. rer. nat. Sarah Strachan, Ph.D.
- Herr Dhanasekaran Rathinam, M.Sc.
- Frau Sarah Bimmermann, M.Sc.
- Frau Srishti Anchan B.Sc.
- Frau Nicole Barwinski M.Sc.
- Frau Merle Lesch, cand. MD
Collaboration partners:
- Prof. Dr. Karl Welte, Universitätsklinikum Tübingen, Germany
- Prof. Dr. David Lyden, Weill Cornell Medicine, New York City, USA
- Prof. Dr. Martin Stanulla, Medizinische Hochschule Hannover, Germany
- Prof Dr. Bernd Giebel, Universitätsklinikum Essen, Germany
- PD Dr. Jadwiga Jablonska, Universitätsklinikum Essen, Germany
- Dr. Hector Peinado, Spanish National Cancer Research Centre (CNIO), Spain
- Dr. Bruno Costa Silva, Champalimaud Foundation, Portugal
- Prof. Dr. Brian Eliceiri, UCSD, San Diego, USA
- PD. Dr. Justine Rudner and Prof. Dr. Verena Jendrossek, Universitätsklinikum Essen, Germany
- PD. Dr. Irina Nazarenko, Uniklinik Freiburg, Germany
- Dr. Christof Winter, Technische Universität München, Germany
- PD. Dr. Christoph Kahlert, Uniklinikum Dresden, Germany
- Prof. Dr. Ulrich Schüller, Universitätsklinikum Hamburg-Eppendorf, Germany
- Prof. Dr. Peter Hoyer and PD. Dr. Anja Büschner, Universitätsklinikum Essen, Germany
- Prof .Dr. Christoph Cremer and Dr. Xiaomin Liu, Max Planck Institutes for Polymer Research and for Chemistry, Mainz, Germany
- Prof. Dr. Joachim Fandrey and Dr. Anna Wrobeln, Universitätsklinikum Essen, Germany
Projects and funding
Hermann-Seippel-Preis – Deutscher Forschungspreis für Kinderheilkunde.
“Double-stranded DNA (dsDNA) in extracellular vesicles (Exosomen) as potential diagnostic marker in pediatric brain tumor (AT-RT)”.
Deutsche José Carreras Foundation Grant. “Extracellular vesicles as novel informative biomarker in pediatric acute myeloid leukemia”.
Transcan 2017, ERA-NET, BMBF. “New strategies to detect cancers in carriers of mutations in RB1: blood tests based on tumor-educated platelets,TEPs, or exosomes”.
Hubertus Trettner Stiftung. “Liquid Biopsy in Relased Ewing Sarcoma (LiBRES)“
Deutsche Forschungsgemeinschaft (DFG). “Diagnostic utility and functional role of exosomes in Head and Neck cancer (HNC).”
Deutsche Kinderkrebsstiftung. “Establishment of a diagnostic approach using extracellular vesicles as potential biomarkers in medulloblastomas and their functional characterization”.
Link zur Publikation:
Seit August 2015 ist Herr Prof. Dr. med. Helmut Hanenberg in der Kinderklinik III tätig. Seine klinisch-translationalen Schwerpunkte sind die Fanconi-Anämie als häufigste angeborene Form des angeborenen Knochenmarksversagens sowie die Entwicklung von genetisch optimierten Zelltherapien bei Erkrankungen der Hämatopoese von Kindern und Jugendlichen.
Die Fanconi-Anämie (FA) ist eine erblich bedingte DNA-Reparaturerkrankung, die klinisch typischerweise durch die Trias aus angeborenen Anomalien, einem chronisch-progedienten Knochenmarkversagen und einer ausgeprägten Neigung zu Malignomen, vor allem AML und Plattenepithelkarzinome des Hals-, Nasen- und Rachenraums und des anogenitalen Bereichs charakterisiert ist. Allerdings besteht in Abhängigkeit von unterschiedlichen Faktoren wie dem defekten FA-Gen, der Art der Mutationen, der ethnische Zugehörigkeit des Patienten und der Expression des Genotyp von Modifiergenen eine große Heterogenität in der klinischen Manifestation der Erkrankung. Deshalb können selbst innerhalb einer Familie mit zwei betroffenen Kindern die klinischen Manifestationen und der genaue Verlauf der jeweiligen FA nicht vorhergesagt werden. Im deutsch-sprachigen Raum werden pro Jahr ca. 25 Patienten mit FA neu diagnostiziert. In einigen ethnischen Populationen wie Roma und Sinti/Gypsies, Inuits/Eskimos, Afrikaans, Ashkenazy-Juden und anderen gibt es sogenannte ‘founder’-Mutationen, so dass die Heterozygotenfrequenz und damit auch die Anzahl der Betroffenen in diesen Populationen deutlich höher liegt.
Pathophysiologisch liegt der FA eine Störung der DNA-Doppelstrangbruch-Reparatur nach Exposition gegenüber kreuzvernetzenden Substanzen zugrunde, wobei das klinische Bild der FA durch Keimbahnmutationen in mindestens 19 verschiedenen FA-Genen verursacht wird. Sie werden als FANC-A/B/C/D1/D2/E/F/G/I/J/L/M/N/O/P/Q/R/S/T bezeichnet. 17 der FA-Gene sind autosomal rezessiv, FANCB ist X-chromossomal rezessiv und FANCR autosomal dominant.
Seit 2013 ist Herr Prof. Hanenberg zusammen mit Herrn Prof. Christian Kratz Leiter des klinischen FA-Registers in Hannover. In diesem klinischen Register werden prospektiv alle klinisch und genetischen Daten der Patienten in Deutschland, Östereich und Teilen der Schweiz gesammelt und ausgewertet. Für die genetische Klassifikation der 19 FA-Gene wird im Labor die Diagnostik mittels Hochdurchsatzsequenzierung aufgebaut. Bei heterozygoten Keimbahnmutationsträgern sind fünf FA-Gene (BRCA1, BRCA2, BRIP1, PALB2, RAD51C) auch etablierte Risikogene für erbliche Tumorerkrankungen.
Das initiale Nichtansprechen oder die Wiederkehr der Leukämie bei Patienten nach der Chemotherapie und auch nach unverwandten Stammzelltransplantation hat eine sehr schlechte Prognose. Hier kann durch die Gabe von immunkompetenten T-Zellen versucht warden, doch noch ein Zurückdrängen der Leukämie und eine Heilung der Patienten zu erreichen. Nach der Stammzelltransplantation können die reifen T-Zellen aus dem Blut der Spender eingesetzt werden, wobei diese wichtige immunologische Behandlungsmethode allerdings zu lebensbedrohlichen akuten immunologischen Reaktionen führen kann. Um diese hochaktiven Zellen im Patienten besser kontrollieren zu können, haben wir ein menschliches Suizidgen entwickelt, dass es ermöglicht in Kombination mit dem Prodrug, diese Zellen im Patienten spezifisch abzutöten. In Zukunft wird es wahrscheinlich möglich sein, auch die eigenen T-Zellen des Patienten durch genetische Veränderungen mit chimären Antigenrezeptoren (CARS) so umzuerziehen, dass diese die Leukämiezellen erkennen und abtöten. Um diese Immuntherapien ebenfalls besser kontrollierbar zu machen, werden wir im Rahmen einer Förderung durch die Deutsche Jose-Carreras Leukämie-Stiftung unser Suizidgensystem in präklinischen Modellen mit den CARS kombinieren und präkliisch austesten.
Kontakt Arbeitsgruppenleitung
Prof. Dr. med. Helmut Hanenberg
Fon +49 201 – 723 – 1053
Fax +49 201 – 723 – 5808
E-Mail schreiben
Entwicklung einer Immuntherapie für akute myeloische Leukämien (AMLs) durch den Einsatz von allogenen natürlichen Killer- (NK-) Zellen mit CD33 CARs (iCAN33)
(Das Projekt wird durch die Europäische Union und das Land Nordrhein-Westfalen gefördert.)
Seit mehr als 30 Jahren werden große Hoffnungen in den Einsatz von Immunzellen zur Bekämpfung von Tumoren gesetzt. Ein wirklicher Durchbruch konnte allerdings zum ersten Mal vor wenigen Jahren durch den Einsatz von sogenannten „Checkpoint“-Inhibitoren sowie von CAR (chimeric antigen receptor) T-Zellen erzielt werden. CAR T-Zellen sind gentechnisch veränderte T-Zellen des Patienten (autolog) und exprimieren einen Rezeptor, der aus einem Antikörper gegen ein Tumorantigen sowie Domänen zur Weiterleitung der aktivierenden Signale besteht. Die CAR T-Zelle wird über die Bindung des Antikörperteils an die Tumorzelle aktiviert und tötet diese dann effektiv ab. In Patienten mit Leukämien der B-Zell-Reihe konnten durch den Einsatz von spezifischen CAR T-Zellen auch in anderweitig austherapierten Fällen gute Heilungsraten von ca. 50% erzielt werden. Allerdings ist die Herstellung dieser Zellen extrem kostenintensiv ($475.000 pro Patient (Novartis)). Darüber hinaus kann häufig, nicht zuletzt bedingt durch die schwerwiegenden Störungen in der Hämatopoese, keine ausreichende Menge an T-Zellen aus dem Blut der Patienten für die Herstellung gewonnen werden. Die Gabe von CAR T-Zellen von Fremdspendern (allogen) stellt dabei keine Option dar, weil die Therapie mit allogenen CAR T-Zellen zu schwerwiegenden Graft-versus-Host (GvH) Reaktionen führt.
Eine mögliche Alternative stellen die „Natürlichen Killer“ (NK)-Zellen dar. NK-Zellen reagieren über spezielle NK-Rezeptoren frühzeitig gegen Tumor- und Virus-infizierte Zellen und töten diese dann sehr effektiv ab. Im Gegensatz zu T-Zellen können allogene NK-Zellen von Fremdspendern in großen Mengen dem Patienten verabreicht werden, ohne GvH-Reaktionen auszulösen. Allerdings reichte in klinischen Studien die natürliche Toxizität der NK-Zellen gegen leukämische Blasten oft nicht aus, um eine langfristige Kontrolle der Leukämie zu ermöglichen. Durch die Modifikation der NK-Zellen mit geeigneten CARs können hier auf vielversprechende Weise die Vorteile der guten Verträglichkeit (auch im allogenen Setting) mit der exzellenten Tumorspezifität der CARs kombiniert werden. In diesem Projekt sollen daher erstmals CAR NK-Zellen in klinischem Maßstab zur Behandlung von Patienten mit akuter myeloischer Leukämie (AML) hergestellt werden. Bei der AML handelt es sich um die prognostisch ungünstigste Leukämieform bei Kindern und Erwachsenen, für die aufgrund der hohen Toxizität bisher auch keine CAR T-Zelltherapie erfolgreich eingesetzt werden konnte.
Das iCAN33 Projekt hat zum Ziel, CAR NK-Zellen mit der Spezifität für das Tumorantigen CD33, welches auf allen AML-Basten exprimiert wird, aus dem Blut gesunder Spender und unter Berücksichtigung aller regulatorischen Hürden herzustellen, um die Voraussetzungen für eine erstmalige CAR NK-Zelltherapie in AML-Patienten zu ermöglichen. Zu diesem Zweck haben sich Experten auf dem Gebiet der NK-Zellfunktion und CAR-Technologie mit Klinikern der deutschen AML-Studiengruppen sowie Miltenyi Biotec als weltweitem Marktführer auf dem Gebiet der klinischen Zelltherapeutika zu einem Konsortium zusammengeschlossen. Das iCAN33 Projekt soll die Grundlagen, Protokolle und präklinischen Daten generieren, um im Anschluss an die Förderung klinische Prüfungen der Phase I/II beantragen und durchführen zu können. Die Herstellung der CAR NK-Zellen wird in large scale-Ansätzen unter Herstellungsbedingungen (GMP-konform) auf der proprietären Technologie-Plattform Prodigy® von Miltenyi Biotec optimiert und beinhaltet die in vivo Testung der Toxizität und Sicherheit dieser Zellen gegen primäre AML-Blasten von Kindern und Erwachsenen im NSG-Mausmodell. Die erfolgreiche Durchführung dieses Projekts wird eine Übertragung der CAR NK-Zell Technologie auf andere nationale und internationale Zentren sowie andere Tumorentitäten sehr vereinfachen. Aufgrund der kostengünstigen, dezentralen Herstellung der Zelltherapeutika für die eigenen Patienten mit ungünstiger AML ist auch die unmittelbare Verfügbarkeit sowie die Nachhaltigkeit und der wirtschaftliche Erfolg dieser Förderung gegeben. Langfristig erlaubt der Einsatz von allogenen CAR NK-Zellen eine De-Personalisierung der Immuntherapie, so dass sie als neue Therapieform in unserem Kampf gegen den Krebs für unser Gesundheitssystem bezahlbar bleibt.
Kontakt Arbeitsgruppenleitung in der Kinderheilkunde III
Prof. Dr. med. Helmut Hanenberg
Fon +49 201 – 723 – 1053
Fax +49 201 – 723 – 5808
E-Mail schreiben
Leukämien – Bösartige Erkrankungen des blutbildenden Systems
Zu den häufigsten Krebserkrankungen im Kindesalter zählen mit 34 % die akuten (ALL , AML) und chronischen Leukämien (CML). Etwa 120 Patienten erkranken in diesem Zusammenhang jährlich an einer akuten myeloischen Leukämie (AML), die sich durch eine große morphologische und molekulargenetische Heterogenität auszeichnet. Die genaue Ursache für das Entstehen einer AML im Kindesalter ist bisher noch weitestgehend ungeklärt. So wird die Existenz einer leukämischen Stammzelle vermutet, die nach dem Erwerb von zusätzlichen Mutationen nicht mehr den normalen Regulationsmechanismenin der Hämatopoese unterliegt und es so zur unkontrollierten Vermehrung von leukämischen Blasten kommt. Eine präzise Identifizierung dieser leukämischen Stammzelle wird wichtige Anhaltspunkte zur Optimierung bestehender Therapieprotokolle und zur Entwicklung neuer Medikamente und Therapieverfahren in der Leukämietherapie bieten.
Fokus unserer Arbeit sind die akuten myeloischen Leukämien, die im Rahmen der AML-BFM-Studiengruppe erforscht werden.
AML-Referenzlabor
Das AML-BFM Referenzlabor und die Studiengruppenzentrale an der Kinderklinik III des UK Essen ist eine zentrale Einrichtung für die bestmögliche Beratung für alle kinderonkologischen Zentren in Deutschland und teilweise Europa bei der Diagnostik und Therapie der AML bei Kindern und Jugendlichen. Bei Diagnose und im Verlauf erfolgt hier die morphologische, immunologische und molekulargenetische Diagnostik aller Patienten. Dieses dient sowohl der Qualitätssicherung als auch der Subgruppenzuordnung. Aus der Kombination von klinischen, morphologischen und genetischen Befunden wird entsprechend der im AML-BFM Protokoll beschriebenem Algorithmen ein individuelles Risikoprofil für den jeweiligen Patienten erstellt und dementsprechend eine Empfehlung zur risikoadaptierten Behandlung ausgesprochen. Zudem erfolgt die umfassende Beratung der Ärzte in den betreuenden Zentren zu Fragen der Therapie oder auch bei Komplikationen. Die Beratung ist rund-um-die Uhr verfügbar.
Neben der Diagnostik der eingesandten Proben und der nachfolgenden Beratung der an der Studie teilnehmenden pädiatrischen Zentren werden auch alle Patienten mit hämatologischen Auffälligkeiten aus der hiesigen Klinik für Kinderheilkunde III im Labor untersucht.
Forschungsprojekte der AG Leukämien
Durch die Tätigkeit für die Studie stehen umfangreiche Materialien für unterschiedliche Forschungsprojekte zur Verfügung. Schwerpunkte der Forschung sind unter anderem die Aufklärung der Leukämie- und Tumorentstehung, die Identifikation besserer Prognosefaktoren und die Entwicklung von besseren und nebenwirkungsärmeren Therapieoptionen.
In der Übersicht werden neben der Routinediagnostik die folgenden Projekte im Labor bearbeitet:
- Molekulargenetische Untersuchungen zur klonalen Evolution und subklonale Hierarchie der leukämischen Blasten bei der AML.
- Identifikation und Charakterisierung der (Prä-)leukämischen Stammzellen mittels Einzelzellanalyse und Next Generation Sequencing (NGS) .
- Untersuchungen zur Interaktion der leukämischen Blasten und dem Mikroenvironment im Knochenmark der AML Patienten.
- Etablierung eines Modells zur humanisierten, extramedullären Knochenmarknische in einem Xenograft-Mausmodell.
- Relevanz der extrazellulären Doppelstrang DNA (Exosomen/Mikrovesikel) für die Diagnostik der AML sowie deren molekularpathologischen Bedeutung für die Erkrankung.
- Durchführung der Quantifizierung der Resterkrankung (MRD) zur Bestimmung des Therapiesprechens (qPCR; Droplet PCR).
- Monitoring der minimalen Resterkrankung zur Erfassung des molekularen Rezidivs.
- Entwicklung von CAR-T-Zell Modellen zur Verbesserung der Therapie bei der AML (präklinisch)
- Entwicklung neuer gentherapeutischer Ansätze bei Hämophilien (präklinisch)
- Durchführung der Referenzmorphologie und Zytochemie von Leukämien/MDS/Knochenmarkversagen
- Immunphänotypisierung (Akute Leukämien, Lymphome, Thrombozytopathien, Immundefekte); Sorting definierter hämatologischer Zellpopulationen und weitergehende Charakterisierung .
Gegenwärtig sind im Labor 2 Ärzte, 2 Wissenschaftler, 3 Doktoranden, 6 technische Assistenten sowie 1 Tiermedizinische Fachangestellte beschäftigt.
Kontakt Arbeitsgruppenleitung
Prof. Dr. rer. nat. Nils von Neuhoff
Fon +49 201 – 723 – 1052
Fax +49 201 – 723 – 5808
E-Mail schreiben
ZNS-Tumoren (ZNS – Zentrales Nervensystem) machen etwa 20% aller Krebserkrankungen im Kindes- und Jugendalter aus (Inzidenz 26 auf 1 Million Kinder im Alter <15 Jahre). In Deutschland erkranken jährlich 400 Kinder und Jugendliche neu an einem ZNS-Tumor. Zu den häufigsten bösartigen ZNS-Tumoren im Kindesalter zählen das Medulloblastom und das Ependymom. Embryonale Tumoren des ZNS (ehemals als ZNS-PNETs bezeichnet) und Pineoblastome machen etwa 5% der ZNS-Tumoren aus. Leider kommt es je nach Entität und Subgruppe bei 35% bis 70% der Patienten mit diesen bösartigen ZNS-Tumoren nach der Ersttherapie zu einem Rezidiv des Tumors oder zu einem Nichtansprechen des Tumors auf die Ersttherapie (absolut ca. 45-50 Patienten je Jahr in Deutschland). Im Mittelpunkt der Forschungstätigkeit der Arbeitsgruppe Neuroonkologie liegen die Beratung von Patienten mit rezidivierten und refraktären ZNS-Tumoren im Kindes- und Jugendalter, die Durchführung und Unterstützung von präklinischen Studien und klinischen Studien bei Patienten mit prognostisch ungünstigen und rezidivierten ZNS-Tumoren. Darüber hinaus arbeitet die Arbeitsgruppe eng mit allen anderen klinischen Studien und Diagnostikstudien des bundesweiten Behandlungsnetzwerks HIT zusammen.
Projekte Klinische Forschung
1. Multinationales multizentrisches Register für Kinder, Jugendliche und junge Erwachsene mit therapierefraktären, progredienten oder rezidivierten Medulloblastomen, Pineoblastomen, primitiv neuroektodermalen Tumoren des ZNS (ZNS-PNETs) und Ependymomen (HIT-REZ-Register)
Unabhängig von der zukünftig eingesetzten Rezidivtherapie ist das HIT-REZ-Register ein multizentrisches Register, in dem eine systematische populationsbasierte Erfassung der klinischen, neuropathologischen und molekularbiologischen Daten aller ersten und mehrfachen Rezidive/Progressionen der o.g. ZNS-Tumorentitäten erfolgt. Es ist in der Diskussion, das HIT-REZ-Register auf andere europäische und transatlantische Länder auszudehnen, die innerhalb der SIOPE-Brain Tumor Group und der COG Brain Tumor Group zusammenarbeiten. Der dort erhobene Datensatz soll einen Vergleich von zu unterschiedlichen Zeiten behandelten Patienten sowie einen Vergleich von unterschiedlichen Behandlungsstrategien innerhalb und außerhalb von klinischen Prüfungen bzw. von individualisierten Behandlungen ermöglichen und als historische Basis für unterschiedliche zukünftige Studienformen dienen. Die Qualitätssicherung der Diagnostik und der lokalen Behandlung wird durch die Nutzung der etablierten Referenzeinrichtungen für die klinische Beratung (Studienzentrale), die Neuroradiologie, Neuropathologie, Radiotherapie und Neurochirurgie gewährleistet. Darüber hinaus soll im Rahmen des Registers im Fall erneuter Tumoroperationen neben der histopathologischen Diagnostik Tumormaterial und gesundes Vergleichsmaterial gesammelt werden 1) für molekularbiologische Untersuchungen als mögliche Basis für eine Ziel-gerichtete individuelle Therapieempfehlung und 2) für zukünftige neuropathologische und molekularbiologische Analysen sowie wenn möglich für in vitro und in vivo Tumormodelle mit dem Ziel mehr über die Tumorentitäten und ihre Subgruppen sowie die Tumorpathogenese und Tumorausbreitung zu lernen.
Förderung durch: Deutsche Kinderkrebsstiftung (DKS)
Studienleitung: Prof. Dr. med. Gudrun Fleischhack
2. Projekte Pharmakokinetik zytostatischer Substanzen
Zusammenarbeit im Rahmen des Projektes: Pharmakokinetik und Populationspharmakokinetik von intraventrikulärer Therapie mit Etoposid Prof. Dr. Ulrich Jaehde, Pharmazeutisches Institut, Universität Bonn und Dr. rer. nat. Ralf Axel Hilger, Westdeutsches Tumorzentrum, Universitätsklinikum Essen (AöR) Innere Klinik, Tumorforschung
Förderung durch: Deutsche Kinderkrebsstiftung (DKS)
Studienleitung: Prof. Dr. med. Gudrun Fleischhack
3. Projekte HIT-2000/I-HIT-MED-Register, SIOP-Ependymoma-II-Studie, SIOP-PNET5-MB-Studie, »HIT-Life -Studienübergreifende, systematische Spätfolgenanalysen bei Überlebenden im Behandlungsnetzwerk HIT«, ZNS-REST-Studiengruppe
Zusammenarbeit mit Prof. Dr. med. S. Rutkowski, Dr. med. M. Mynarek, Universitätsklinikum Hamburg-Eppendorf, Klinik für Pädiatrische Hämatologie und Onkologie, Frau PD Dr. med. Katja von Hoff und Frau PD Dr. med. G. Tallen Charité-Universitätsmedizin Berlin, Campus Virchow-Klinikum, Kinderklinik, Pädiatrische Hämatologie/Onkologie
4. Projekte Phase I/II/III-Studien mit DKFZ/KiTZ Heidelberg, der Pharmaindustrie und der ITCC
Diese Studien schließen Patienten mit rezidivierten ZNS-Tumoren im Kindes- und Jugendalter ein.
- DKFZ/KiTZ Heidelberg: INFORM2-Studie
- Fa. Novartis: CDRB436G2201 (Phase II, Prüfung Kombination aus Dabrafenib/Trametinib – BRAF-/MEK-Inhibitor),
- Fa. Boehringer Ingelheim: BI-Trial 1200.120 (Phase I/II Prüfung Afatinib – Multi-HER-Inhibitor),
- Fa. Bristol-Myers Squibb: CA209908 (Phase I/II Nivolumab/Ipilimumab – PD1 und CTLA-4-Antikörper)
- Fa. Janssen Research & Development: JNJ-42756493 (A Phase 2 Study of Erdafitinib in Subjects with Advanced Solid Tumors and FGFR Gene Alterations)
5. Projekt »Genetische Krebsprädisposition«/»Li-Fraumeni-Register«
Zusammenarbeit mit Prof. Dr. med. Christian Kratz, Medizinische Hochschule Hannover, Zentrum für Kinderheilkunde und Jugendmedizin, Klinik für Pädiatrische Hämatologie und Onkologie
6. Projekt »Personalized Intensity-Modulated Therapy in Post-Pubertal Patients with Newly-Diagnosed Medulloblastoma – PersoMed-I, EORTC 1634«
Zusammenarbeit mit Prof. Dr. P. Hau, Universitätsklinikum Regensburg, Neurologische Klinik
Projekte Translationale Forschung
1. Doppelstrang-DNA (dsDNA) in extrazellulären Vesikeln (Exosomen) als potentieller diagnostischer und prognostischer Biomarker bei rhabdoiden Tumoren des Kindesalters
Von Tumorzellen abstammende Exosomen (Vesikel) haben sich als potentiell wertvolle Biomarker herausgestellt, da sie erkrankungs-spezifische Proteine, Lipide und genomische Signaturen aufweisen, welche die jeweilige Ursprungszelle repräsentieren. Das macht sie potentiell wertvoll zur Überwachung des Therapieansprechens oder zur Detektion eines eventuellen Therapieversagens oder Rezidives.
Ziel unseres Projektes ist es, am Beispiel der genetisch gut definierten Gruppe kindlicher rhabdoider Tumore nachzuweisen, dass Exosomen mit DNA der Tumorzellen im Blut nachweisbar sind und man diese zum Monitoring des Krankheitsverlaufes nutzen kann. Diese Erkenntnisse werden in der Zellkultur und verschiedenen Mausmodellen gewonnen und anschließend auf den Patienten übertragen und im Rahmen einer klinischen Studie evaluiert. Nach Etablierung dieser Methode am Beispiel dieses hochmalignen kindlichen Tumors, könnten diese Erkenntnisse auf andere solide Tumore inklusive anderer Hirntumore des Kindes- und Erwachsenenalters übertragen werden.
Hauptantragsteller: Dr. Basant Kumar Thakur und Dr. Stephan Tippelt von der Kinderhämatologie und -onkologie der Kinderklinik III, Universitätsklinikum Essen und PD Dr. Kornelius Kerl vom Universitätsklinikum Münster
Förderung durch: Hermann-Seippel-Preis – Deutscher Forschungspreis für Kinderheilkunde
2. Establishment of a diagnostic approach using extracellular vesicles (EVs) as potential biomarkers in medulloblastomas and their functional characterization.
In dieser Studie sollen zwei Hauptfragestellungen bearbeitet werden:
- Etablierung einer Methode zur Isolierung, Charakterisierung und Quantifizierung der in den EVs enthaltenen Tumor-dsDNA, in vitro an verschiedenen Medulloblastom-Zelllinien und in vivo zu verschiedenen Zeitpunkten einer Erkrankung.
- Aufklärung der Rolle und Interaktion der von den Medulloblastomzellen freigesetzten EVs mit naiven Zellen des ZNS zur Klärung ihrer Rolle in der Metastasierung des Medulloblastoms und einer möglichen malignen Transformation dieser Zellen.
Zur Beantwortung dieser Fragestellungen planen wir, im ersten Schritt EVs von Medulloblastom-Zelllinien und in einem zweiten Schritt EVs aus Blutproben von Patienten mit Medulloblastomen mittels Nanoparticle Tracking Analysis Plattform und BCA Methode zu isolieren und mittels einer PCR basierten Charakterisierung auf verschiedene Medulloblastom-typische Mutationen hin zu analysieren. In einem weiteren Schritt werden wir isolierte und charakterisierte EVs mit Zellen von gesundem Ursprungsgewebe des ZNS zusammen kultivieren und mögliche Beeinflussungen des sensiblen Mikroenvironments analysieren. Zusammenfassend ist das Ziel unserer Studie eine Charakterisierung der in EVs von Medulloblastomzellen enthaltenen dsDNA, die Prüfung ihrer Eignung als potenzieller Biomarker für Medulloblastome sowie die Untersuchung ihrer Rolle bei der Entstehung von Rezidiven und Metastasen.
Förderung durch: Deutsche Kinderkrebsstiftung (DKS)
Hauptantragsteller: Basant Kumar Thakur, MSc, PhD
Klinische Kollaboration: Dr. med. Stephan Tippelt, Prof. Dr. med. Gudrun Fleischhack
3. Synergistische Effekte von Gold-Nanopartikeln und Protonenbestrahlung bei der Behandlung von Hirntumoren im Kindesalter (SYNGOPRO)
In der Literatur haben mehrere Forschungsgruppen einen verstärkenden Effekt der Bestrahlung von verschiedenen Tumoren mit Protonen durch Gold-Nanopartikel in präklinischen Modellen beschrieben. Gold-Nano Partikel sind gut verträglich, wobei Langzeit-Untersuchungen zur Verträglichkeit noch ausstehen. In ersten Versuchen am WPE haben die Projektpartner zeigen können, dass bei kultivierten Tumorzellen Gold- Nanopartikel die Wirkung von Protonenstrahlen verstärken. Langfristig ergibt sich hierdurch die Chance, die zur Heilung notwendige Strahlendosis und damit das Risiko von Spätfolgen bei Kindern mit Hirntumoren absenken zu können und dabei doch dieselbe heilende Wirkung zu erzielen.
In unserem Projekt wollen wir durch eine Kooperation der Zentren für Nanointegration (CENIDE) und Medizinische Biotechnologie (ZMB) der Universität Duisburg Essen, des Westdeutschen-Protonentherapie-Zentrums und des Forschungslabors der Kinderonkologie am Universitätsklinikum Essen die potentiell synergistischen Effekte von Gold-Nanopartikeln und Protonenstrahlung an kindlichen Hirntumoren in vitro und in vivo weiter erforschen. Hierzu soll besonders auf die Spezifität kindlicher Hirntumore eingegangen werden, und die Effekte mit Variation der Strahlendosis sowie der Nanopartikelbeschaffenheit untersucht werden.
Ziel dieses Projektes ist es, die verstärkenden Effekte von Gold-Nanopartikeln auf Tumorzellen nach Bestrahlung auf kindliche Hirntumorzellen zu übertragen und dies in weiteren Schritten im Tiermodell zu bestätigen. Hierdurch könnte zukünftig durch die Kombination von Nanopartikeln und Protonen eine schonendere Strahlentherapieform schwer heilbaren Kindern mit Hirntumoren zur Verfügung gestellt werden. Die hierfür notwendigen Expertisen und technischen Voraussetzungen sind in der notwendigen idealen Kombination nur in Essen in NRW vorhanden, werden in diesem Projekt zusammengeführt und bieten das Potential eine zukunftsweisende Therapieentwicklungen voranzutreiben.
Förderung durch: Europäische Fonds für regionale Förderung (ERFE.NRW)
Hauptantragsteller: Prof. Dr. med. Beate Timmermann, Klinik für Partikeltherapie, Universitätsklinikum Essen; Dr. med. Stephan Tippelt, Klinik für Kinderheilkunde III, Universitätsklinikum Essen; Prof. Dr. med. Alexander Schramm, Westdeutsches Tumorzentrum (WTZ), Universitätsklinikum Essen; Prof. Dr. ing. Stephan Barcikowski, Zentrum für Nanointegration (CENIDE), Technische Chemie I, Universität Duisburg-Essen; Dr. Maike Müller, Zentrum für Medizinische Biotechnologie (ZMB), Universität Duisburg-Essen
4. Projekte Neuropath 2.0 und MNP-IntR, PTT2.0, INFORM-Register, Tumorbanking
Zusammenarbeit mit Prof. Dr. med. T. Pietsch, Universitätsklinikum Bonn, Institut für Neuropathologie, Prof. Dr. med. U. Schüller, Universitätsklinikum Hamburg-Eppendorf, Institut für Neuropathologie, Prof. Dr. med O. Witt, Prof. Dr. med. S. Pfister, PD Dr. med. T. Milde, PD Dr. K. Pajtler, Universitätsklinikum Heidelberg, Abt. Päd. Hämatologie, Onkologie, Immunologie und Pneumologie & Klinische Kooperationseinheit Pädiatrische Onkologie/Abt. Pädiatrische Neuroonkologie, Deutsches Krebsforschungszentrum, Hopp Kindertumorzentrum Heidelberg
5. Projekt »Targeting the hedgehog pathway in pediatric cancers«
Deutsche Krebshilfe Projekt im Bereich »Translational Oncology«, Zusammenarbeit mit Frau Prof. Dr. med. Simone Fulda, Universitätsklinikum der Goethe-Universität Frankfurt am Main, Institut für Experimentelle Tumorforschung in der Pädiatrie
Team
Prof. Dr. med. Gudrun Fleischhack
Dr. med. Stephan Tippelt
Ruth Mikasch
Julia Zeller
Eicke Schürmann
Cand. med. Jonas Adolph
Cand. med. Christine Gaab
Phytotherapien (Pflanzliche Medikamente) stellen einen festen Bestandteil der traditionellen Medizin fast aller Kulturen dar und werden auch in der modernen Medizin häufig als alternativen Krebstherapie oder als Begleittherapie der konventionellen Zytostatika,- oder Radiotherapie eingesetzt. Zudem wurden vormals viele der heutzutage konventionell eingesetzten zytostatischen Substanzen aus Pflanzen isoliert oder sind daraus durch chemische Modifikation abgeleitet. So gehören die Vinca Alkaloide, Epipodophyllotoxine, Camptothecine und Taxane zu den klinisch relevanten Zytostatika pflanzlichen Ursprungs. Nachwievor ist das Interesse an bioaktiven Naturstoffen ungebrochen.
Obwohl sich die Therapiemöglichkeiten von Kindern mit Krebs in den letzten Jahren deutlich verbessert haben, gibt es in der Pädiatrie immer noch Tumorarten mit schlechter Prognose. Die insgesamt ermutigenden Erfolge können zudem nur durch risikoreiche, mit vielen Nebenwirkungen und in der Regel lang andauernden Therapien erreicht werden.
Komplementärmedizin und Alternativmedizin (CAM) sind Sammelbezeichnungen für unterschiedliche Behandlungsmethoden und diagnostische Konzepte, die sich als Ergänzung oder Alternative zu schulmedizinischen Behandlungsmethoden verstehen, wie sie klassisch an Universitäten gelehrt werden. Aktuelle Befragungen in Deutschland zeigen, dass ca. 35% der Kinder in der Kinderonkologie Komplementärmedizin bekommen, wobei die Misteltherapie eine der häufigsten Therapien darstellt. Ziel der aktuellen Forschung ist es, Medikamente aus der Komplementärmedizin auf ihre Wirkung auf Tumorzellen zu untersuchen, um einerseits im Rahmen einer Supportivtherapie den Patienten und die konventionelle Therapie zu unterstützen und um andererseits neue Therapien für die Behandlung von Krebs zu finden. Insbesondere liegt unser Schwerpunkt dabei auf den soliden Tumoren des Kindesalters, dem Neuroblastom, dem Medulloblastom und dem Retinoblastom.
Projekt: Evaluation cytotoxischer Effekte von Viscum album-(Mistel) Extrakten
Die Weißbeerige Mistel (Viscum album L.) wird seit ihrer Einführung in die Onkologie in den 1920er Jahren durch Rudolph Steiner mit steigender Häufigkeit auch bei Kindern eingesetzt. Die Pflanze enthält eine Vielzahl pharmakologisch aktiver Inhaltsstoffe, von denen die Mistellektine am besten erforscht sind. Es handelt sich hierbei um bifunktionelle Moleküle, die aus zwei disulphidisch miteinander verknüpften Ketten aufgebaut sind. Die B-Kette erlaubt eine hochspezifische Erkennung und Bindung von Kohlenhydratstrukturen, während die A-Kette eine N-Glykosidaseaktivität aufweist. Trotz des zunehmenden klinischen Einsatzes in der pädiatrischen Onkologie und zahlreicher Untersuchungen der Wirkungen auf adulte Tumorzellen, sind die Effekte auf kindliche Tumoren bislang kaum erforscht. Ziel dieses Projektes ist die Analyse der Einflüsse von Mistelextrakten auf Tumorentitäten der Kinderonkologie, auch im Vergleich zur Erwachsenenonkologie.
Gefördert durch: Fa. Wala, Fa. Abnoba, intern
Projekt: Evaluation cytotoxischer Effekte von Taraxacum e planta tota Urtinktur (Fa. Wala) auf Tumorzellen der Kinder- und Erwachsenenonkologie sowie vergleichende Untersuchungen zu den Mistelextrakten Iscucin Pini und Iscucin Tiliae
Taraxacum (Löwenzahn) ist eine Pflanzengattung aus der Familie der Korbblütler (Asteraceae). Sie wird als Heilpflanze in der Anthroposophischen Medizin, der TCM wie auch in der Homöopathie seit vielen Jahren angewendet. Die wenigen Labor-Studien zeigen, dass Taraxacum eine zytotoxische Wirkung auf Krebszellen in vitro und wohl auch in vivo ausübt. Jedoch gibt es noch keine systematischen Untersuchungen und die Wirkmechanismen sind weitgehend ungeklärt. In nicht publizierten Falldarstellungen wurde von einem möglichen klinischen Potential bei Patienten mit gynäkologischen Tumoren mit dem Präparat Taraxacum e planta tota D3 (WALA Heilmittel GmbH) berichtet. Die in vitroWirkung von Taraxacum e planta tota (WALA Heilmittel GmbH) wurde bis jetzt aber nicht untersucht.
Mit dem vorliegenden Projekt soll die Wirksamkeit von Taraxacum e planta tota im Vergleich zu Iscucin® Pini und Iscucin® Tiliae in der Kinderonkologie und Erwachsenonkologie erforscht werden.
Gefördert durch: Fa. Wala
Projekt: Entwicklung einer Mistellektinmessung, um die Misteltherapie bei Kindern verbessern zu können
Bei der Anwendung von Misteltherapien erfolgt die Dosierung zur Zeit ohne Beachtung pharmakokinetischer Kenngrößen und zwar individuell angepasst an die Krankheitslage, das Allgemeinbefinden, den Immunstatus und die Reaktion auf die Therapie. Nachteilig dabei ist, dass auf diese Weise keine exakte Dosiseinstellung möglich ist. Kenntnisse zur Kinetik von Mistellektinen sind nun allerdings für das therapeutische Behandlungskonzept essenziell, um überhaupt Dosis-Wirkungsbeziehungen aufstellen zu können. Das Forschungsprojekt zielt auf die Etablierung eines sensitiven Verfahrens zur Quantifizierung und Isolierung von Mistellektin-I aus biologischen Matrices zur Ermittlung der Pharmakokinetik. Desweiteren sollen die bereits bekannten Verfahren zur Quantifizierung von Mistellektinen einer vergleichenden Bewertung unterzogen werden.
Gefördert durch: Günter und Regine Kelm Stiftung
Projekt: Evaluation cytotoxischer Effekte von Curcumin und Thymoquinon auf pädiatrische Tumorzellen
Curcumin wird aus der ayurvedischen Heilpflanze Curcuma longa L. extrahiert und hat durch beschriebene hemmende Wirkungen auf Cyclin D1 die Aufmerksamkeit als mögliches Tumortherapeutikum erregt. Weiterhin wurde eine Hemmung der Cyclooxygenase-2 (COX-2), und eine Verminderung der Expression von Matrixmetalloproteinase-9 (MMP-9) und verminderte Aktivierung von EGF-R (epidermal growth factor receptor), beschrieben. Die antitumoralen Wirkungen, die bislang für Curcumin auf adulte Tumorzellen beschrieben wurden, sollen nun für pädiatrische Tumorzellen verifiziert werden.
Auch für das aus aus dem Schwarzkümmel (Nigella sativa) stammende Thymoquinon, für das antitumorale Wirkungen über verschiedene potentielle Targets, einschließlich p53, p73, STAT3, NF-κB, PPAR-γ und reaktive Sauerstoffverbindungen (ROS) beschrieben wurden, soll auf Effekte auf pädiatrische Tumorzellen hin untersucht werden.
Gefördert durch: Prof. Dr. med. Alfred Längler, Professur für integrative Kinder – und Jugendmedizin, Universität Witten/Herdecke
Kontakt Arbeitsgruppenleitung
PD Dr. med Tycho Jan Zuzak
Leitender Oberarzt Kinderhämatologie und -onkologie
Anthroposophische Medizin (GAÄD und FMH)
Abteilung für Kinderonkologie und -hämatologie
Gemeinschaftskrankenhaus Herdecke gemeinnützige GmbH
Fon +49 2330 – 62 – 2183
Fax +49 2330 – 62 – 3220
Das Retinoblastom ist der häufigste intraokulare Tumor des Kindes- und Jugendalters mit einer Inzidenz von 1:20.000. Es entsteht in Folge von Mutationen des Tumorsuppressorgens RB1 auf Chromosom 13, welches für ein Protein kodiert, das in seiner phosphorylierten Form den Zellzyklus in der G1-Phase arretiert.
Das Fehlen eines funktionsfähigen Rb-Proteins führt zu einer unkontrollierten Proliferation der betroffenen Zelle. Das Retinoblastom kann einseitig (60%) oder beidseitig (40%) auftreten. Es gibt eine erbliche und eine nicht-erbliche Form des Tumors.
In Europa wird das Retinoblastom meistens bereits diagnostiziert, wenn es noch auf das Auge beschränkt ist. Invasives Wachstum führt oftmals zu einer Infiltration des Sehnervens (Nervus opticus) oder der Aderhaut. Bei großen Tumoren muss meistens eine Entfernung des betroffenen Auges (Enukleation) erfolgen. Augenerhaltende Therapien umfassen systemische oder lokale Chemotherapien, fokale Therapien wie Photokoagulation, Kryotherapie oder Brachytherapie. Eine externe Bestrahlung ist eine sehr wirksame Therapiemethode, die aufgrund der Nebenwirkungen nur sehr selten angewendet wird.
Ungeachtet einer mit 90% ausgezeichneten Überlebensrate ist die therapiebedingte Morbidität bei Retinoblastompatienten durch den Verlust von Netzhautarealen oder des kompletten Auges hoch. Zahlreiche Patienten mit beidseitigem Retinoblastom entwickeln nach Jahren einen Zweittumor, wobei die strahlen- und chemotherapeutische Behandlung eine maßgebliche Rolle zu spielen scheinen. Dementsprechend liegen die Hauptziele der aktuellen Forschung auf der Untersuchung der Tumorentstehung und der Identifizierung neuer Therapieansätze zur Reduktion der Therapiemorbidität.
Unsere Forschungsarbeiten sind in die klinische Forschungsgruppe »Ophthalmologische Onkologie und Genetik« am Universitätsklinikum Essen eingebunden.
Drittmittelförderung
Die Projekte werden unter anderem gefördert von:
- Bundesministerium für Bildung und Forschung
- Deutsche Forschungsgemeinschaft
- Deutsche Kinderkrebsstiftung
- Kinderaugenkrebsstiftung
- Wilhelm Sander-Stiftung
- Fight Kids Cancer
Projekte: Translationale Forschung
Schwerpunkte der Forschung sind die Entwicklung von nebenwirkungsärmeren Therapieoptionen und Methoden zur Früherkennung von Retinoblastom und Zweittumoren.
- CoBioRB: Collaborative study to identify Biomarkers to adjust treatment intensity for children with Retinoblastoma
- MYTargetRB – Auswirkung von MYCN auf die Tumorprogression von Retinoblastomen und Blockade des Signalweges als zielgerichtete Therapie (DFG)
- Detektion der minimalen disseminierten Tumorzellen beim Retinoblastom (KAKS)
Projekte: Klinische Forschung
Da das Retinoblastom eine sehr seltene Erkrankung ist, existieren wenige Daten für eine risikoadaptierte, evidenzbasierte Auswahl der verschiedenen Therapien. Aus diesem Grund werden in dem deutschland- und österreichweiten klinischen Register RB-Registry prospektiv Daten zur Epidemiologie und dem Krankheitsverlauf des Retinoblastoms erfasst werden. Das langfristige Ziel des klinischen Registers und der weiteren klinischen Forschungsprojekte ist die Verbesserung der Überlebensraten der Patienten mit fortgeschrittenen Tumorstadien sowie die Verminderung von Langzeitfolgen und Verbesserung der Lebensqualität aller Langzeitüberlebenden.
- RB-Registry: klinisches Register zur Epidemiologie und Krankheitsverlauf des Retinoblastoms in Deutschland und Österreich (DKKS)
- GenSeC I und II – Auswirkung von genetischen Faktoren auf die Inzidenz, Lokalisation und Histologie von Zweittumoren bei Patienten mit erblichem Retinoblastom (Wilhelm Sander-Stiftung)
- Spätfolgen bei Patienten nach Behandlung eines Retinoblastoms.
- EURbG – European Retinoblastoma Group, weitere Informationen hier.
Team
Prof Dr. Petra Ketteler
PD Dr. Stefan Schönberger
Bettina Appel
Wibke Eckhardt
Studienzentrale
Fon +49 201 – 723 – 2003
Fax +49 201 – 723 – 79002
E-Mail schreiben
Nur wenige Akutkliniken bieten eine behandlungsbegleitende Sport- und Bewegungstherapie im Rahmen der Regelversorgung onkologisch erkrankter Kinder und Jugendlicher an. Die Folgen sind ein wissenschaftlich belegter starker Leistungsverlust und die Verstärkung inaktivitätsbedingter Spätfolgen der medizinischen Therapie. Unsere Arbeitsgruppe untersucht im Rahmen verschiedener Forschungsprojekte die Umfänge und Intensitäten körperlicher Aktivitäten und die sportmotorische Leistungsfähigkeit von Kindern und Jugendlichen in unterschiedlichen Behandlungsphasen und evaluiert die Wirksamkeit bewegungstherapeutischer Maßnahmen zur Reduzierung der Krankheitslast. Wir arbeiten eng mit nationalen und internationalen Arbeitsgruppen sowie Fachgesellschaften zusammen.
Forschungsschwerpunkte
Bewegungstherapie während einer allogenen Stammzelltransplantation (ANIMAL Studie)
Kinder und Jugendliche mit Leukämie, die mit einer allogenen hämatopoetischen Stammzelltransplantation (allo-HSCT) behandelt werden, haben ein hohes Risiko für lebensbedrohliche Infektionen und transplantationsbedingte Komplikationen. Der Erfolg und das Überleben nach einer allo-HSCT korrelieren eng mit der Immunrekonstitution und insbesondere der Anzahl der natürlichen Killerzellen (NK-) um Tag 30 nach der Transplantation. Im Allgemeinen kann körperliche Aktivität die Immunzellen einschließlich der NK-Zellen als Hauptzellpopulation des angeborenen Immunsystems bei Gesunden und in Patientenpopulationen erhöhen. In der allo-HSCT beeinflusst angeleitete Sporttherapie die Fitness und die psychologischen Parameter positiv. Daher wird diese explorative Studie die Auswirkungen strukturierter und an den Patienten angepasster Bewegungsprogramme auf NK-Zellen und andere Immunrekonstitutionsparameter sowie auf das Gesamtergebnis von Kindern und Jugendlichen während einer allo-HSCT evaluieren (DRKS00019865).
Körperliche Aktivität bei Kindern und Jugendlichen in der Krebsnachsorge (PACCS Studie)
Das internationale Forschungsprojekt PACCS (Physical Activity in Childhood Cancer Survivors) mit Studienleitung in Norwegen, untersucht, wie sich der Krebs und die Behandlung auf verschiedene Aspekte im Zusammenhang mit der körperlichen Aktivität bei Kindern auswirken. Die Ergebnisse des Forschungsprojektes werden dazu beitragen Angebote zur Bewegungsförderung zu etablieren und erweitern. Diese können Kindern und Jugendlichen helfen, in ihren Alltag zurückzukehren, die Freude an Bewegung wieder aufzubauen und Spätfolgen der Behandlung zu reduzieren. Teilnehmen können Kinder und Jugendliche im Alter von 9 bis 15 Jahren mit mindestens einem Jahr Abstand zum Therapieende. In Essen werden insgesamt 150 Kinder und Jugendliche in die Studie eingeschlossen. Die Teilnahme umfasst eine Befragung der Kinder und Jugendlichen sowie eines Elternteils und eine objektive Aktivitätsmessung der Kinder und Jugendlichen im Alltag. (www.paccs.no)
Netzwerk ActiveOncoKids
In unserer Arbeitsgruppe sind die Koordinatorin und Sprecherin des deutschlandweiten Netzwerk ActiveOncoKids, sowie die Leitung der ActiveOncoKids Group (wissenschaftliches Netzwerk der DFG) verortet. Das Netzwerk hat zum Ziel, über den Aufbau von Versorgungsstrukturen und Forschungsprojekten, an Krebs erkrankten Kindern, Jugendlichen und jungen Erwachsenen den Zugang zum Sport zu ermöglichen. Auf der Forschungsebene befassen wir uns unter anderem mit der Analyse der Sicherheit bewegungstherapeutischer Maßnahmen in der Kinderonkologie. In Kooperation mit der Fakultät für Sportwissenschaften der Ruhr-Universität Bochum bieten wir als ActiveOncoKids Zentrum Ruhr Natursportangebote für Kinder, Jugendliche und junge Erwachsene in der Krebsnachsorge an. (www.activeoncokids.de und Nachsorgeangebote)
Team
Dr. rer. medic. Miriam Götte
Ronja Beller
Gabriele Gauß
Christopher Blosch
Simon Basteck
Kontakt Arbeitsgruppenleitung
Dr. rer. medic. Miriam Götte
Fon +49 201 – 723 – 8083
Fax +49 201 – 723 – 6247
E-Mail schreiben
Etablierung eines Virus-freien Goldnanopartikel (AuNP)-basierten Gentransfersystems, das als anwenderfreundliches Arzneimittel zur einfachen intravenösen Anwendung am Menschen geeignet ist und unter Berücksichtigung der aufgezeigten Sicherheitsbedenken herkömmlicher Gentransfersysteme mögliche Risiken eliminiert.
Dazu wird ein bereits im Konsortium vorhandenes zirkuläres DNA-Konstrukt so verändert, dass nicht-humane Bestandteile wie z.B. der virale Promotor oder der bakterielle Backbone mit Neomycin-Resistenz eliminiert werden. In unserem Ansatz wird dann die Virus-freie zirkuläre DNA mittels linearem Polyethylenimin (PEI) an lasergenerierte vollständig Liganden-freie Goldnanopartikel gebunden, sodass sie unter Beachtung arzneimittelrechtlicher Vorschriften zum Einsatz im humanen Organismus geeignet ist. Dieser modulare Aufbau des Medikaments bestehend aus einem AuNP-Kern, dem Transfektionsliganden (PEI), einer geeigneten Targeting-Einheit (z.B. PreS1-Peptid oder leberspezifisches PEI) und dem entsprechenden Vektor (FVIII, FIX) ist wenig immunogen und daher zur wiederholten Applikation anwendbar.
Wichtig ist auch, dass das Wirksystem von GeneticGold, also die Kombination von AuNP mit PEI und DNA, jederzeit auch für andere Erkrankungen anwendbar ist.
Team
Prof. Dr. med. Helmut Hanenberg
Dr. May-Kristin Holz
